- 글번호
- 1134887
세포의 항상성 유지와 관련한 단백질 분해 기전과 이와 관련한 질병의 원인/치료법 제시 (Studies of cellular homeostasis regarding protein degradation and their application to cure cellular degenerative diseases)
- 작성자
- 이고은
- 조회수
- 84
- 등록일
- 2024.09.06
- 수정일
- 2024.09.06
(1) 노인성 황반변성의 발병 기작 규명과 새로운 치료제 개발 연구
Autophagy and KRT8/keratin 8 protect degeneration of retinal pigment epithelium under oxidative stress. (2016) Autophagy
Autophagosome–lysosome fusion is facilitated by plectin‑stabilized actin and keratin 8 during macroautophagic process. (2022) Cellular and Molecular Life Sciences
노화가 진행됨에 따라 세포의 항상성이 망가지게 되어 나타나는 여러 질병의 분자기전을 규명하고 치료제를 개발하는 것을 목적으로 연구 진행중이다.
노화가 진행됨에 따라 망막 중심부인 황반에 변성이 일어나면서 시야 중심부가 흐려지고 왜곡되는 황반변성은 50대 이상 중장년 및 노년층에서 실명을 일으키는 주된 질병 중 하나이다. 상이 맺히는 망막 중심부인 황반의 기능이 손상되어 시야의 중심부터 점점 시력이 저하되면서 점차 실명에 이르게 되는데, 세포 대사 찌꺼기를 주로 포함하는 드루젠(drusen)이 망막층과 그 아래 존재하는 기저막 사이에 축적되어 나타난다.
'Self+Eating’의 합성어인 Autophagy는 세포의 항상성 유지에 중요한 역할을 하는 대사작용으로, 세포가 영양소 고갈, 산화 스트레스 등의 극한 상황에서 불필요한 단백질 혹은 손상된 세포 소기관 등을 스스로 분해하여 재사용하는 과정을 일컫는다. 이전 연구에서 황반변성 환자와 정상인 방수의 단백질 비교분석을 통해 케라틴8 단백질을 새로운 황반변성 질병 마커로 선정하였고, 케라틴8이 세포 내 자가포식작용을 향상시켜 망막색소상피세포를 보호함을 규명하였다.
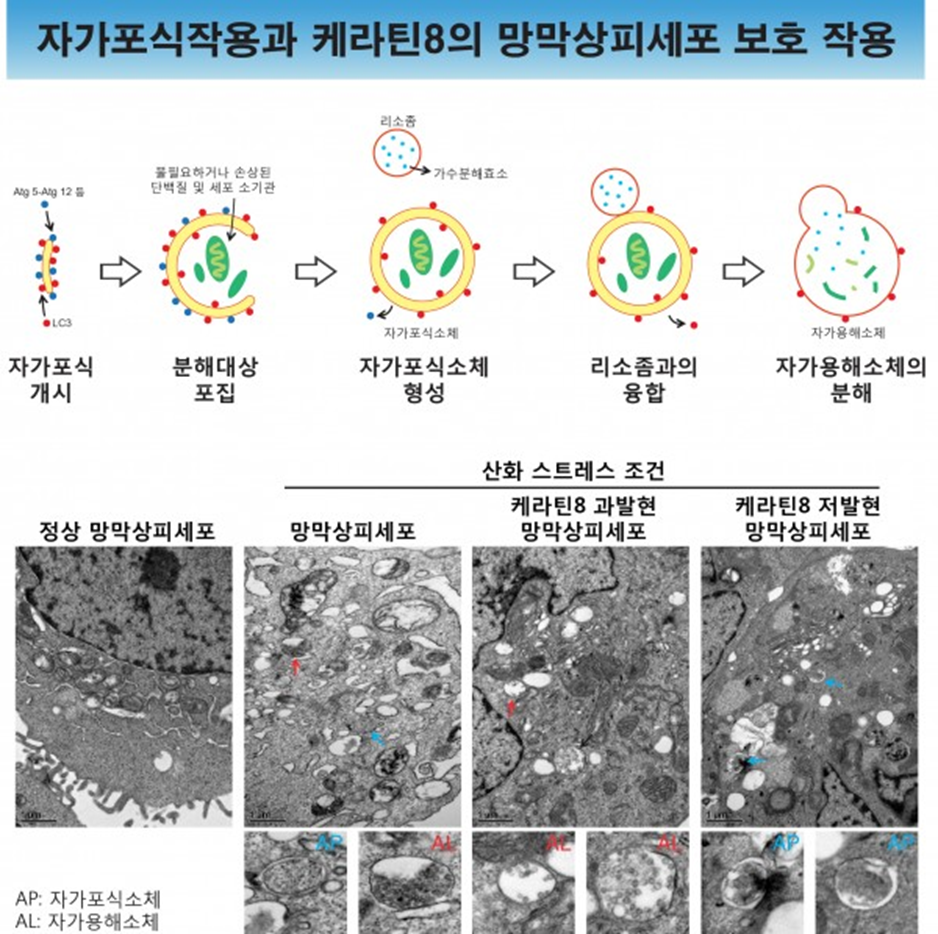
그림 1 산화 스트레스 조건에서 망막색소상피세포 내 자가포식작용과 케라틴8의 보호역할 규명
또한, 중간 섬유체인 케라틴8이 산화 스트레스 조건에서 세포의 자가포식 작용을 촉진하는 현상이 액틴 필라멘트의 구조적 완전성을 지원하는 중간 세포골결 케라틴8 뿐만 아니라 사이토링커 (cytolinker) 플렉틴에 의해 안정화된 액틴 필라멘트에 의해 도움을 받게 됨을 검증하였다.
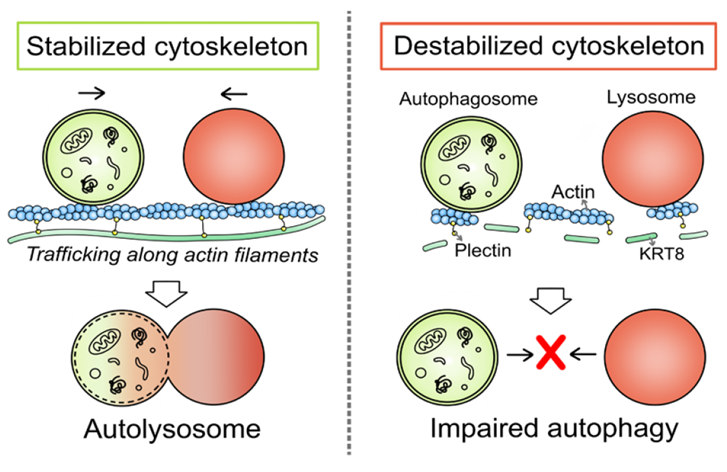
그림 2 망막색소상피세포 내 자가포식과정 동안 중간섬유체 케라틴8의 역할 규명
추가적으로, 산화 스트레스로 활성화된 MAPK1에 의해 케라틴8이 인산화되고 핵 주변으로 재배열이 일어나게 되는데, 이러한 케라틴8의 변화는 망막색소상피세포의 상피세포성을 잃게 하고 간엽세포화를 유도하여 망막색소상피세포 고유의 시각기능을 잃게 하는 상피-중간엽변성 epithelial-mesenchymal transition, EMT)을 초래함을 관찰했다. 연구팀은 케라틴8의 인산화와 재배열을 막기 위하여, MAPK1 억제제의 효과를 조사하였고, MAPK1의 억제제 투여로, 망막색소상피세포와 황반변성 마우스 모델의 망막조직 변성을 억제하는데 성공하였다.
이 연구결과는 황반변성에 유용한 치료제 개발의 단서가 될 것으로 기대되며, 케라틴8의 인산화라는 약물작용점을 타겟으로 하여 망막색소상피세포의 변성을 막을 수 있는 약물 스크리닝 및 기존의 약물(항암제)을 활용한 신약 재창출을 목표로 한 후속연구로 진행 중에 있다.
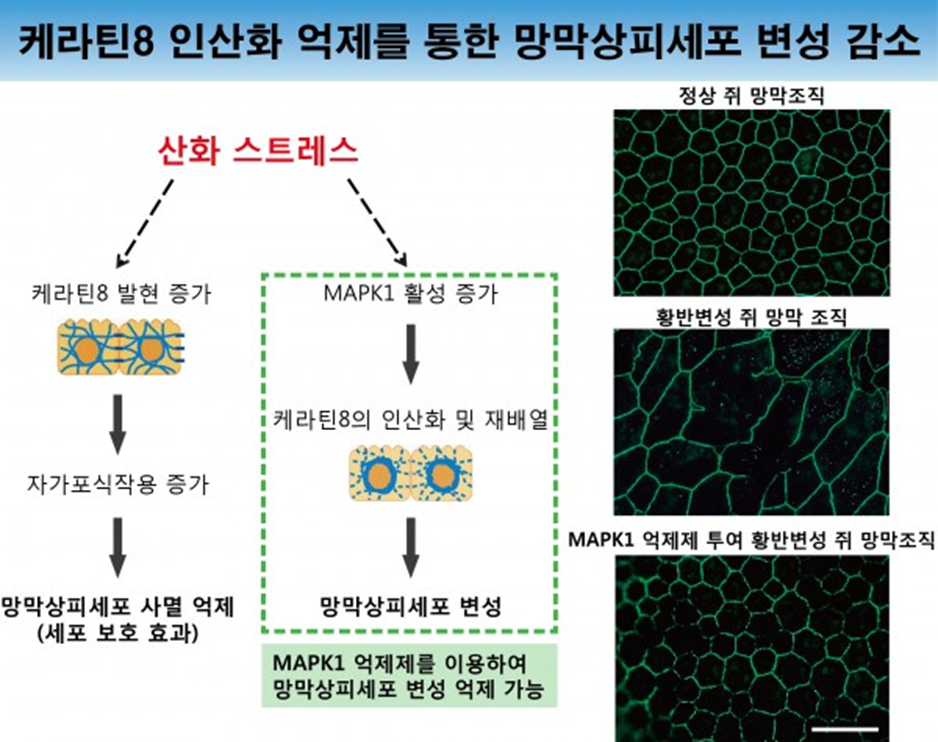
그림 3 케라틴8 인산화 및 재배열 억제로 망막색소상피세포의 변성 완화 확인
(2) 세포내 산화스트레스 조건에서 AMPK 활성화를 통해 α-synuclein 응집체의 분해와 미토콘드리아 항상성 유지 연구
Enhanced autophagic flux through AMPK activation attenuates α-synuclein aggregates and maintains homeostatic population of functional mitochondria under oxidative stress
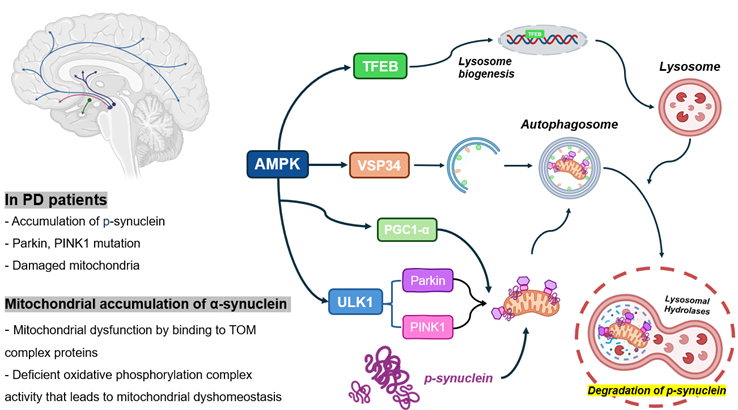
파킨슨병(Parkinson's disease)은 신경퇴행성 질환으로 활성산소(ROS)에 의해 뇌의 substantia nigra 영역에서 α-synuclein 단백질이 축적되면서 도파민 수치가 감소하는 특징이 있다. 여러 연구에 따르면 미토콘드리아 기능 장애는 파킨슨병의 중요한 개시 인자로 확인되며 이는 과도한 ROS 방출로 악화된다. 이러한 ROS의 축적은 즉시 제거되지 않으면 세포 사멸을 초래할 수 있다.
AMPK(5'-AMP-activated protein kinase)는 세포의 에너지 균형을 유지하며 세포내 소화과정인 자가포식(Autophagy)을 조절하는데 기여한다. 현재 연구에서는 세포의 산화스트레스 조건에서 AMPK 활성화를 통해 자가포식 과정을 촉진하여 α-synuclein 응집체의 분해와 미토콘드리아 항상성 유지에 대한 효과를 관찰하는 것을 목적으로 연구 진행중이다.
(3) 염증성 장질환에서 면역프로테아좀 억제를 통한 NLRP3 인플라마좀의 조절 및 장 장벽보호
Inhibition of immunoproteasome attenuates NLRP3 inflammasome formation in tumor necrosis factor α-stimulated intestinal epithelial cell. Biochem Biophys Res Commun
Inhibition of Immunoproteasome Attenuates NLRP3 Inflammasome Response by Regulating E3 Ubiquitin Ligase TRIM31. Cells
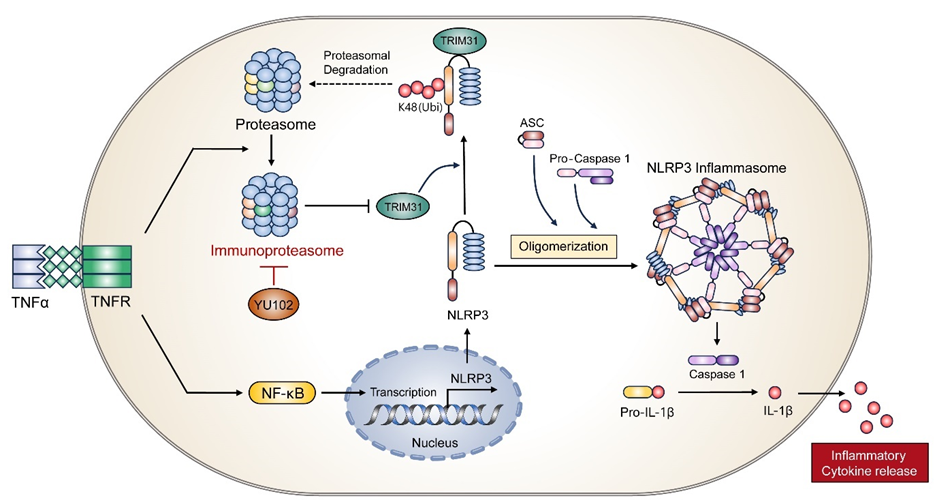
TNFα와 같은 염증성 사이토카인은 NLRP3 인플라마좀 형성을 유도하여 IBD의 병인에 기여하는 염증성 사이토카인 분비를 증가시킨다. TNFα는 또한 면역 서브유닛 LMP2, LMP7, MECL-1을 포함하는 면역 프로테아좀(Immunoproteasome, IP)의 형성을 촉진한다.
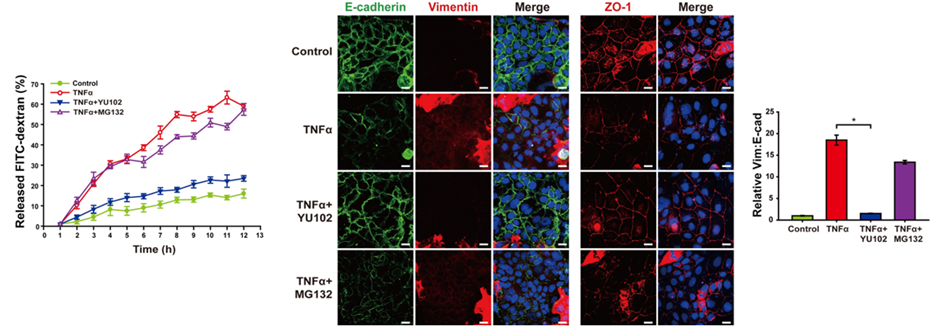
본 연구에서 LMP2를 특이적으로 억제하는 IP 특이 억제제 YU102를 사용하여 IP의 활성을 억제하였을 때, NLRP3 단백질 수준이 감소하고 K48-연결된 폴리유비퀴틴화가 증가하는 것을 관찰하였다. 또한, IP 억제는 유비퀴틴 E3 리가아제인 TRIM31의 단백질 수준을 증가시켜 NLRP3 분해를 촉진함을 검증하였다.
추가 실험으로, 마우스 모델에서 YU102를 투여한 결과 대장염 증상이 완화되며, 장 상피에서 NLRP3 단백질 수준과 염증성 사이토카인의 분비가 억제됨을 확인하였다. 이는 염증 상태에서 IP 억제를 통해 TRIM31 매개 NLRP3 분해가 촉진되어 장벽 파괴를 유발하는 염증 반응을 감소시킬 수 있음을 검증하였다.
종합적으로, TNFα가 IBD에서 염증성 사이토카인 분비와 NLRP3 인플라마좀 형성을 증가시키며, IP 활성화에 관여함을 밝혔다. IP 특이 억제제 YU102의 사용은 K48-연결된 폴리유비퀴틴화와 TRIM31을 통한 NLRP3 분해를 증가시켜 마우스 모델에서 염증 반응과 장벽 파괴를 유의미하게 감소시킴을 검증함을 통해 IP 억제가 IBD 치료에 효과적인 전략이 될 수 있음을 시사하였다.